IRB
GC녹십자의료재단
임상연구심의위원회를 소개합니다.
IRB는 연구의 과학적ㆍ윤리적 타당성을 심의하여 연구 대상자의 권리, 안전, 복지를 보호하기 위해 설치된 자율적ㆍ독립적 심의기구입니다.
IRB는 생명윤리 및 안전에 관한 법률, 체외진단의료기기법, 의료기기법 등 관련 법규들을 준수하여 인간대상연구, 인체유래물연구, 체외진단의료기기 임상적 성능시험 심사위원회를 운영하고 있습니다.
IRB의 권한과 의무
IRB는 연구계획 및 승인된 연구에 대해 다음 각 호의 권한과 의무를 가집니다.
-
1) IRB는 외부 기관 또는 연구자로부터 심의 요청된 연구에 대하여 다음의 사항을 심의한다.
- 연구계획서의 윤리적ㆍ과학적 타당성
- 연구대상자 등으로부터 적법한 절차에 따라 동의를 받았는지 여부
- 연구대상자 등의 안전에 관한 사항
- 연구대상자 등의 개인정보보호 대책
- 그밖에 생명윤리 및 안전에 관해 필요한 사항
- 2) IRB는 연구계획의 검토를 위해 연구자에게 추가적인 정보 제공을 요구 하거나 회의 참석을 요청 할 수 있다.
- 3) IRB는 필요한 경우 위원회에서 승인된 연구과제의 수행 중 진행과정 및 결과에 대하여 조사ㆍ감독한다.
- 4) IRB는 해당 연구의 연구대상자에게 미치는 위험 정도에 따라 연구책임자에게 적절한 주기로 보고하도록 하고 이를 지속심의 한다. 지속심의 주기는 최대 1년을 넘길 수 없다.
- 5) IRB는 승인된 연구의 수행과정에서 연구대상자 등을 적절하게 보호할 수 있어야 한다.
- 6) IRB는 수행 중인 연구에 대한 조사ㆍ감독 중 예기하지 않았던 중대한 위험 또는 중대한 관련 법률의 위반 등 생명윤리 및 안전에 중대한 위협이 있다고 판단되는 경우, 심의를 거쳐 해당 연구에 대한 제한ㆍ중지 혹은 보류를 결정할 수 있다.
-
7) 그 밖에 생명윤리 및 안전을 위한 다음 각 목의 활동을 한다.
- 해당 기관의 연구자 및 종사자 교육
- 취약한 연구대상자 등의 보호 대책 수립
- 연구자를 위한 윤리지침 마련
- 8) IRB는 그 밖에 보건복지부장관이 정한 고시에 따른 업무를 수행하여 해당 사항에 대한 적절한 조치를 취할 수 있다.
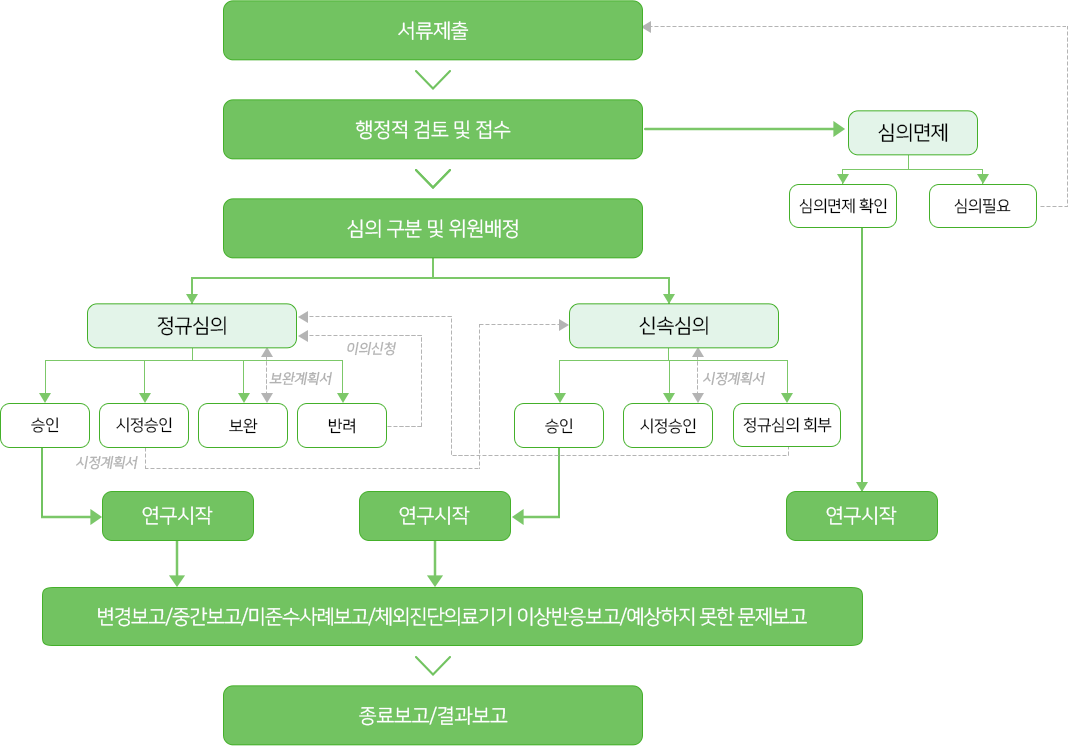
심의절차
심의 일정 및 공지사항
- 정규심의 : 매월 둘째·넷째 주 화요일 (정규심의 일정은 공휴일 또는 원내 일정상 조정될 수 있음)
- 신속심의 : 수시 개최 (심의 면제 포함)
- 심의제출서류/연구자윤리지침/심의비/교육안내 등 자세한 내용은 eIRB 홈페이지(http://eirb.gcrl.co.kr)에서 확인 가능합니다.
접수 문의
- Tel : 031-260-9688,9236
- Email : irb@gclabs.co.kr