진단검사 검체취급
실시간 모니터링이 가능한 검체운송시스템으로
검체 안정성을 최적화합니다.
일반혈액검사(Complete Blood Count)
- 혈액 3.0mL을 채취하여 EDTA 용기에 넣고 용기를 위 아래로 5~10회 정도 전도혼합하여 항응고제와 혈액이 충분히 섞이도록 합니다. 이때, 항응고제 (EDTA)와 혈액량의 비율이 적합하지 않거나, 혼합이 불충분할 경우 미세한 응고가 생겨 세포수 계산 등 검사결과의 오차가 발생할 수 있으므로 주의합니다.
- 검사는 2시간 이내에 이루어져야 하지만 즉시 검사할 수 없을 경우에는 4℃에서 냉장 보관하며, 24시간까지는 CBC 결과가 안정합니다.
- 실온에서 6시간 이상 방치 시 MCV, ESR, PLT, WBC count, reticulocyte (2일 내 소실) 등 결과에 영향을 미칠 수 있습니다.
- 냉동 보관된 검체는 분석이 불가능합니다.
혈액도말검사(PB Morphology)
- 신선한 혈액을 사용하여 얇고, 고르게 도말 슬라이드를 제작하며, 도말의 길이는 약 3~4 cm가 좋습니다.
- 미는 슬라이드는 깨끗하고 미는 면은 매끄러워야 혈구 파괴가 없는 좋은 슬라이드가 되며, 슬라이드는 신속하게 건조시켜야 세포 변형을 방지할 수 있습니다.
- 혈구의 형태감별을 위한 검사는 일반혈액검사와 함께 의뢰하거나 귀원의 검사실에서 실시한 검사의 결과지와 도말 슬라이드, 소견서를 첨부하여 주시면 정확한 임상진단과 결과 판독에 도움이 됩니다.
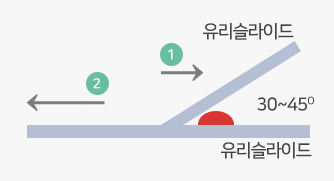
혈액응고검사(Blood Coagulation Test)
- 응고검사를 위한 검체는 수액을 맞고 있는 쪽에서는 채혈을 피하고, 조직액 혼입을 방지하기 위해 첫 번째 튜브에 채혈하지 않도록 합니다.
- 헤파린 오염의 우려가 있는 카테터(catheter)로 채혈하는 경우 5.0mL 또는 catheter dead space volume의 6배를 뽑아낸 후 검체를 채취합니다.
- 즉시 검사를 시행하지 못하는 경우 혈소판결핍혈장(platelet poor plasma, PPP)을 분리하여 냉동보관하는데, 일반적으로 -20℃에서 2주, -70℃에서 약 6개월까지 보관 가능합니다.
- 응고검사 중 Factor II(2) ~ XII(12) 등의 항목은 표준 혈장의 응고시간과 환자의 응고시간을 비교하여 환자 혈장내 특정 응고인자의 활성도를 %로 나타내는 검사로서 검체 안정성이 지연될 경우, 응고인자가 소모되어 활성도가 거짓 감소될 수 있으므로 반드시 혈소판 결핍 혈장을 분리하여 냉동으로 보관해야 합니다.
- 작은혈구응괴(microaggregation), 섬유소 가닥(fibrin strand), 용혈이 있는 부적합 검체일 시 검사결과의 오류를 초래할 수 있으므로 다시 채혈하도록 합니다.
- 실온보관 상태에서 채혈 후 두 시간 이내에 원심분리하고, 대부분의 혈액응고검사는 혈소판결핍혈장(platelet poor plasma, PPP)을 필요로 하므로 2,500G에서 15분 이상 원심분리하여 혈소판을 완전히 제거하는 것이 중요합니다.
- Hct의 값이 45%일 때, 항응고제(3.2 % sodium citrate)와 혈액량의 비율은 1:9로 채혈합니다. Hct의 값에 따른 항응고제와의 혈액량의 비율은 다음 표와 같습니다.
Hct 결과에 따른 항응고제와 혈액량의 비율
| Hct | 6% | 20% | 30% | 45% | 55% | 63% | 70% |
|---|---|---|---|---|---|---|---|
| Ratio | 1 : 5 | 1 : 6 | 1 : 7 | 1 : 9 | 1 : 11 | 1 : 13 | 1 : 16 |
세포면역검사(Lymphocytes Subset)
- K2 EDTA 용기를 사용하여 3.0mL을 채취한 후 반드시 실온 보관하며, 토요일 및 공휴일 전날 검체 접수 삼가하여 주시기 바랍니다(검체에 검체채취 일시 기재).
- 4℃ 보관 또는 림프구 분리 후 보관은 양성률이 낮으며 CD8 세포에 비하여 CD4 세포가 저하될 수 있습니다.
Interferon-gamma releasing assay
- 전용용기는 4~25℃에서 보관하며, 냉장 보관 시 사용 1시간 전에 실온에 두었다가 사용합니다.
- 전용용기에 환자이름과 채취시간을 기입합니다.
Interferon-gamma releasing assay [GC Labs 코드: N971]
- 반드시 회색(Nil) → 녹색(TB1 antigen) → 노랑(TB2 antigen) → 보라(Mitogen)용기 순서로 1.0 mL씩 검은 선까지 채혈합니다.
-

① 회색(Nil) 용기
-

② 녹색(TB1 antigen) 용기
-

③ 노랑색(TB2 antigen) 용기
-

④ 보라색(Mitogen) 용기
Interferon-gamma releasing assay (TB-Feron) [GC Labs 코드: W566]
- 반드시 회색(Nil) → 빨강(TB antigen) → 보라(Mitogen)용기 순서로 1.0 mL씩 검은 선까지 채혈합니다.
-

① 회색(Nil) 용기
-
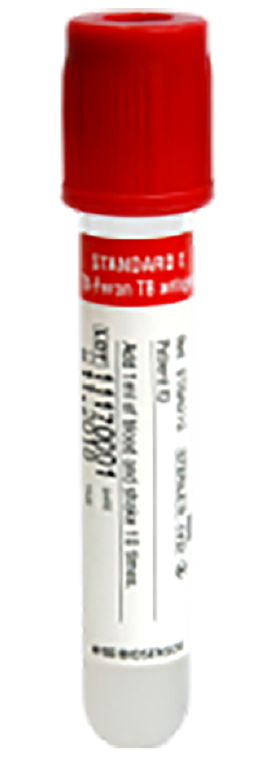
② 빨간색(TB antigen) 용기
-
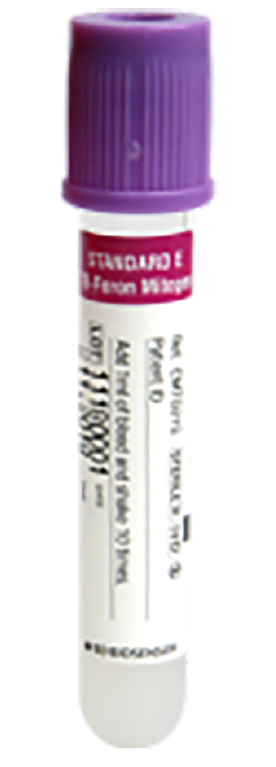
③ 보라색(Mitogen) 용기
- 채혈 후 즉시 전용용기 벽면의 내용물(antigen)이 혈액과 잘 섞일 수 있도록 상하로 10회, 또는 5초 동안 반복 혼합합니다.
- 반드시 세워서 16시간 이내에 본원에 도착해야 합니다.
- 채혈 시 전용용기의 검은 선까지가 채혈 튜브의 코팅물질과 혈액이 반응할 수 있는 최적의 범위이므로 채혈량을 반드시 준수해야 합니다.
- 채혈량이 0.8 mL 이하의 경우 리튬헤파린 용기에 추가 채혈하여 보충이 가능하나, 1.2 mL 이상의 경우는 재 채혈을 해야 합니다.
NK세포 활성도 검사
- 전용용기는 냉장 보관하며 채혈 직전 냉장고에서 꺼내 사용합니다.
- 전용용기에 환자의 정보(이름 및 채혈시간)를 기재하고 End marker까지 약 1 mL를 채혈합니다.
- 채혈 후 전용용기 안쪽 면 전체에 혈액이 코팅되도록 8~10회 정도 상하로 혼합합니다.
-
전용용기는 채혈 즉시, 또는 채혈 후 30분 이내에 37℃ 인큐베이터로 옮겨 20~24시간 동안 세워서 배양합니다.
(채혈 후 배양 전까지 냉장이나 냉동 보관하지 않습니다.) - 배양이 완료된 전용용기에서 상층액을 채취해 1.5 mL tube로 옮깁니다.
- 수거된 상층액을 원심분리 한 후(13,000rpm, 1분), 상층액을 새로운 1.5 mL tube로 옮겨 의뢰합니다.
치료약물농도감시(therapeutic drug monitoring, TDM)
- 독성이 의심되는 경우, aminoglycoside 또는 항결핵제 등에 대해서는 최고 농도일 때 채혈하여 모니터링하지만, 일반적으로 다음 복용 직전인 최저농도를 측정하여 모니터링합니다.
- 대부분의 약물은 혈중 농도 측정 시 혈청 또는 혈장 검체를 이용하나, cyclosporine, tacrolimus, everolimus, sirolimus 등은 전혈 검체를 이용해야 합니다.
- 추적관찰 시 일정한 시간에 검체채취가 이루어지는 것이 바람직합니다.
산전기형아검사
-
검사 의뢰 시 산전관련검사 의뢰서의 기재사항은 반드시 작성하여 첨부합니다.
: 임신주수, 실제 생년월일, 환자 등록번호, 체중, 인슐린의존성 당뇨 유무, 임신초기 검사인 경우 CRL (crown rump length) 및 NT (nuchal translucency).
- 임신 주수(시기)별 검사의 종류는 아래의 표와 같습니다.
임신주수(시기)별 검사종류
| 검사시기 | 분류 | 검사항목 | 검체량 |
|---|---|---|---|
| 임신 10~13주 | 선별검사 | First trimester test (PAPP-A, Free β-HCG) | 혈청0.5mL |
| Integrated test 1차(PAPP-A) | |||
| Sequential test 1차(PAPP-A, Free β-HCG) | |||
| 임신 14~22주 | Triple marker test (AFP, uE3, hCG) | 혈청 0.7mL | |
| Quad marker test (AFP, uE3, hCG, Inhibin-A) | |||
| Integrated test 2차(AFP, uE3, hCG, Inhibin-A) | |||
| Sequential test 2차(AFP, uE3, hCG, Inhibin-A) | |||
| 임신 15~22주 | 생화학 정밀검사 | AFP(양수) | 양수 2.0mL |
| Acetylcholinesterase 정성 | 양수 3.0mL |
선천성대사이상검사
채취 시기
- 건강한 신생아의 가장 이상적인 채혈 시기는 48~72시간(일반적으로 퇴원 전 채혈) 사이에 하는 것이 좋습니다.
- 특정 아미노산의 혈중 증가율은 질환의 심각성이나 단백질 섭취량에 따라 달라지므로 너무 일찍 검사를 실시하는 경우 위음성을 초래하며, 정상 신생아는 출생 직후 TSH의 갑작스러운 증가(surge)가 있어 출생 후 48시간 이전에 채취한 검체에서 갑상선기능저하증에 대한 위양성 결과를 초래할 수 있습니다.
- 입원 기간이 연장되는 미숙아 등에서는 생후 7일 정도에 검체를 채취하는 것이 좋으며, 입원일이 14일을 초과하는 경우는 퇴원 시, 1개월 이상일 경우는 1개월째 재검을 하는 것이 바람직합니다.
- 수혈이 필요한 경우는 가능하면 수혈 받기 전 초기 검체를 채취하도록 합니다. 이때, 생후 24시간 이내인 신생아는 생후 30일 및 60일에 재검을 실시하는 것이 좋습니다. 또한, 채혈지에 수혈 후 검체를 채취하였다는 내용과 함께 가장 최근 수혈한 날짜를 반드시 기재하여 의뢰합니다.
- 충분히 수유를 한 후에 혈액여과지에 채혈하는 것이 좋습니다. 수유 상태가 좋지 않은 미숙아 또는 저출생아는 5~7일 사이에 채혈하되 수유 상태가 좋아지면(생후 2주경) 다시 채혈합니다. 만일 생후 48시간 이내에 채혈한 경우, 재검을 권장합니다.
채취 방법
- ① 혈액여지(blood paper)를 이용하여 신생아 발뒤꿈치의 모세혈관에서 혈액을 채취합니다.
- ② 발에 혈류를 증가시키기 위해 다리를 심장보다 아래쪽에 위치하도록 하고, 3분 정도 따뜻한 물수건으로 뒤꿈치를 감싸 발을 따뜻하게 합니다.
-
③ 발뒤꿈치의 외측부를 소독한 일회용 란셋(2.4mm point 이하)을 이용하여 천자합니다.
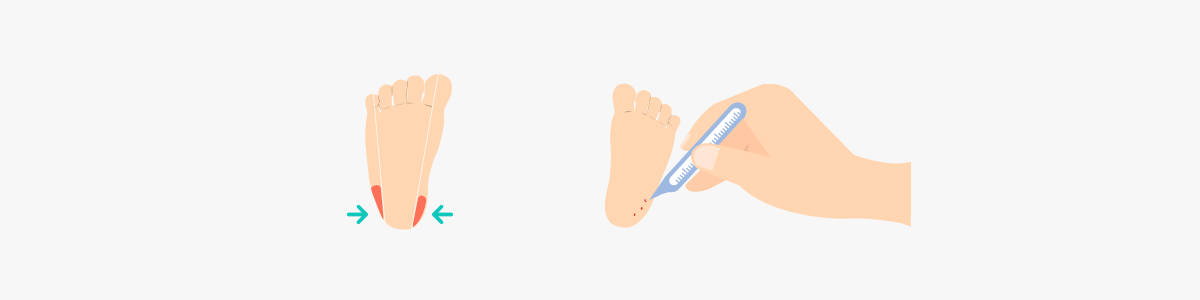
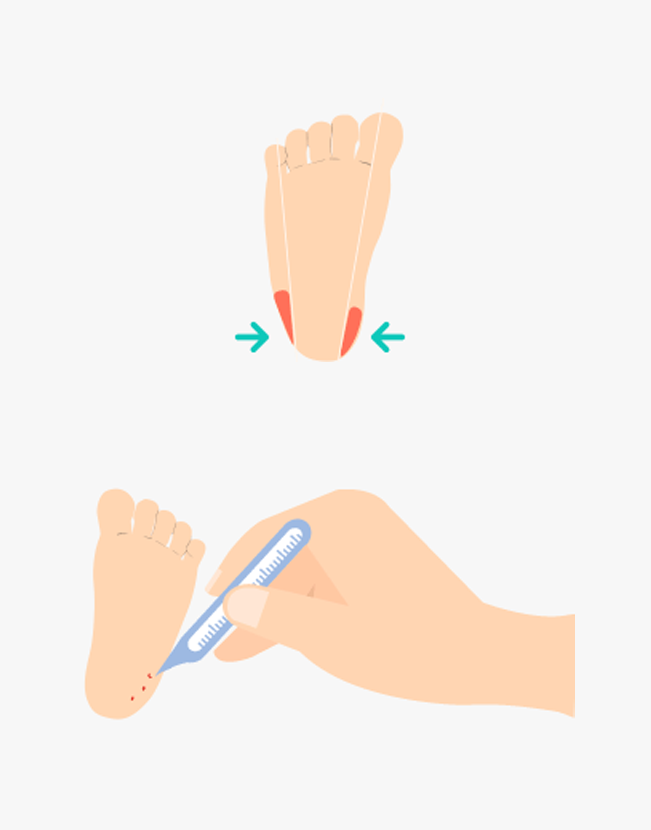
- ④ 처음 나온 혈액 한 방울을 닦아 낸 후 혈액여지의 한쪽 면을 발뒤꿈치의 혈액방울에 접촉한 후 뒷면까지 혈액이 충분히 스며들었는지 확인합니다.
- ⑤ 혈액여지 4개의 원에 가득 차게 혈액을 스며들도록 채혈합니다.
- ⑥ 채혈이 끝난 혈액여지는 표면에 오염물질이 없는 평평한 곳에서 3~4시간 정도 충분히 건조 시킵니다.
- ⑦ 혈액여지가 완전히 건조되면 검체 비닐봉투에 넣어 의뢰합니다.
- 오염을 막기 위해 혈액여지에 그려진 원을 손으로 절대로 만져서는 안됩니다.
- 물이나 알코올, 방부제, 로션, 파우더 등에 닿지 않도록 주의합니다.
- 혈액여지를 채혈부위에 대고 누르거나, 채혈부위를 쥐어짜면 안됩니다.
- Capillary 용기를 사용하여 채취하면 불충분하고 균일하지 못한 혈액흡수의 원인이 되므로 사용하면 안됩니다.
- 혈액을 혈액여지 한쪽 면에만 묻혀 스며들도록 합니다.
-
혈액여지는 오염물질이 없는 평평한 곳에서 실온상태로 3~4시간 정도를 충분히 건조합니다.
수직으로 매달아두거나 세워서 건조 또는 보관하면 혈액성분이 흘러내려 혈청분리가 일어날 수 있습니다. - 혈액여지가 열이나 직사광선에 직접적으로 노출되지 않도록 합니다.
- 혈액여지가 완전히 건조되기 전에는 봉투 속에 넣지 않습니다. 충분히 건조 시키지 않고 비닐 백이나 봉투에 밀봉하면 혈청 분리 혹은 균류나 곰팡이 증식 원인이 될 수 있습니다.
- 환자 정보가 빠짐없이 기재되었는지 확인합니다(반드시 출생 시 체중 필요).
- 바코드는 혈액여지 앞면의 blood spot 밑면에 위치하도록 부착합니다.

Oligomerized amyloid β (알츠하이머위험도검사)
- Vacutainer 21~23G 니들을 이용하여 sodium heparin 튜브에 80% 이상 채혈합니다.
- 채혈 후 혈액과 튜브 내 항응고제가 충분히 섞이도록 튜브를 부드럽게 8~10회 뒤집거나, roll mixer를 이용하여 혼합합니다.
- 채혈 후 최대 3시간 이내에 3,000 rpm 속도로 10분간 원심분리 합니다. 감속 시 브레이크를 사용하지 않고 천천히 감속하여야 합니다.
- 원심분리 후 제공된 폴리프로필렌(polypropylene, PP) 재질의 전용 마이크로튜브(1.5mL) 2개에 각각 0.5 mL 이상 채워 상층 분리한 즉시 -20℃ 냉동 보관합니다(폴리스티렌(polystyrene, PS), 폴리에틸렌(polyethylene, PE) 재질 사용 불가).
-
-

Sodium heparin 튜브에 80% 이상 채혈
-

3,000 rpm 10분
-
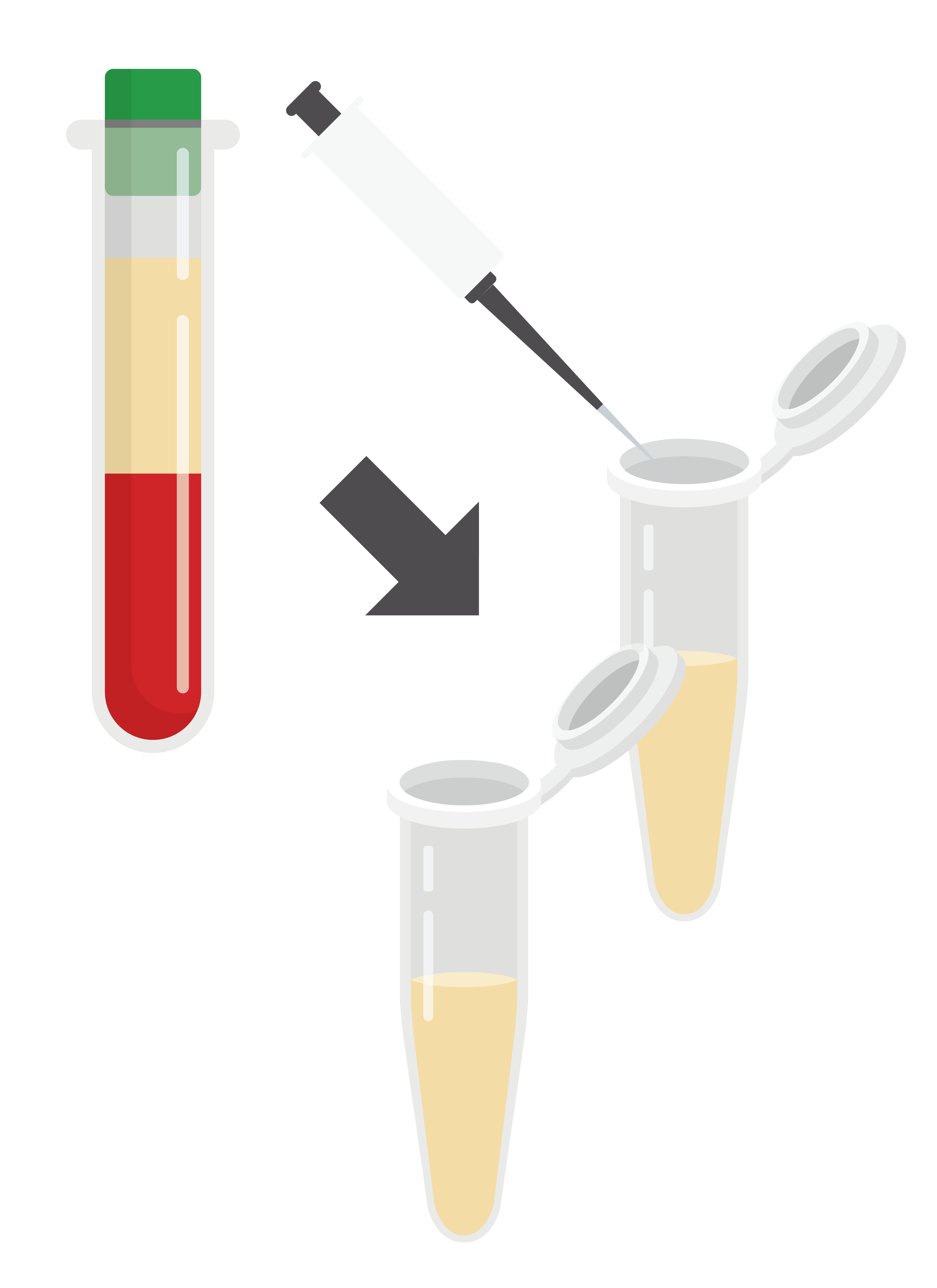
상층 분리
-

-20℃ 냉동 보관
타액호르몬검사
- 4개의 전용용기 microtube에 오전(AM 6:00~8:00), 정오(PM 12:00~1:00), 오후(PM 4:00~5:00), 저녁(PM 10:00~AM 12:00)순으로 검체 채취하고 Kit 겉면에 검체 채취시간을 표기합니다.
- 1번 튜브에 동봉되어 있는 빨대를 입에 댄 후 자연스럽게 빨대를 통해 튜브로 침이 모이게 합니다. 채취 후 튜브는 Kit 안에 차수에 맞게 끼워 냉동 보관합니다(시간대별 총 4회 실시).
- 구강 내 염증이나 상처가 있을 경우, 심한 운동이나 급격한 감정 변화가 있는 상태에서는 타액을 채취하지 않습니다.
- 검체 채취 날은 카페인 섭취 및 흡연을 삼가합니다.
- 흡연이나 음식물 섭취 시에는 30분 후 타액을 채취합니다.
- 양치, 구강세척제 사용은 제한하고 검체 채취 10분 전 물(생수)로 입안을 헹구도록 합니다.
Stone analysis
- 환자에게 깨끗한 통과 미세한 그물망이 달려 거를 수 있는 장치를 주어 환자가 그물망을 통해 소변을 거를 수 있도록 합니다.
- 결석을 찾았다면 깨끗한 통에 넣어 말리고 결석이 커서 빠져 나오지 못하는 경우 비뇨기과 전문의가 체외 충격파 쇄석술(ESWL) 혹은 수술적 제거를 통해 제거한 후 의뢰합니다.
- 결석 외에 조직이나 테이프 같은 물질로 오염되지 않도록 주의합니다.
- Urine, tissue 검체는 부적합합니다.
- 용기 파손에 주의하며, 밀봉한 후 의뢰합니다.
세균검사
- 정확한 감염부위와 적절한 시기에 채취해야 합니다.
- 세균 배양 검사를 위하여 검체를 채취하는 가장 좋은 시점은 발병 초기이며 가능한 항생제 투여 전에 검체를 채취합니다.
- 모든 검체는 지정된 멸균용기에 채취하고 분변 이외의 검체는 무균조작으로 시행되어야 하며 면봉, 시험관, 수송배지, 혈액배양배지 등은 사용 전에 오염 여부나 유효기간을 확인한 후 사용합니다.
- 혈액배양배지, 수송배지는 실온에 보관하며, 수송배지로 검체를 보낼 때는 반드시 2개의 면봉 모두에 검체를 잘 묻혀서 건조되지 않도록 배지에 깊이 찔러 넣어 보냅니다.
- 임상소견, 검체종류 및 채취부위와 시간, 항생제 투여 여부를 기재하여야 하며 검체채취는 통상적으로 항생제 투여 전에 합니다.(기재된 정보에 따라 1차 접종배지의 종류, 배양조건, 동정을 요하는 균의 종류 등이 달라질 수 있으므로 반드시 기재합니다.)
- 수송배지를 즉시 배양할 수 없을 때는 냉장 보관하여 운송합니다. 단, 수막구균이나 임균 등의 Neisseria 균속이나 Haemophilus 균속이 의심되는 검체는 30℃ 이하로 내려가면 사멸하므로 실온이나 37℃에 보관합니다.
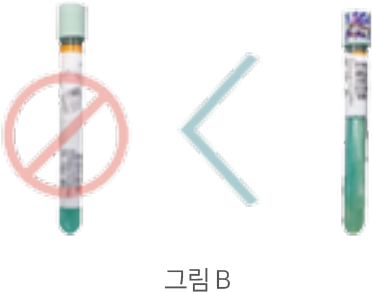
- 혈액배양에 붙어있는 바코드가 보존되도록 발행 된 바코드를 다른 위치에 세로로 부착합니다 (그림 A).
- 균주 검체를 의뢰할 경우 균주를 확인할 수 있도록 사면을 가리지 않는 위치에 바코드를 부착하여 의뢰합니다 (그림 B).

검체별 채취 방법
혈액(blood)
- 검체채취 시 피부 정상균의 오염을 방지하기 위해 피부소독용 알코올, 요오드액으로 소독 후 충분히 건조하여 채혈하는 것이 중요합니다.
- 항생제 사용 전에 채혈하여야 하고, 채혈시기는 오한이 나기 직전이 균수가 가장 많은 적절한 시기이지만 예측할 수 없으므로 열이 나면 바로 채혈을 시행하고 시간차이 없거나 짧은 시간 내에 동시에 다른 부위에서 24시간 내 2~3회 혈액을 채혈합니다.
- 성인은 보통 1회에 정맥에서 20.0 mL를 채혈한 후 호기성과 혐기성 혈액배양병에 동량을 나누어 접종합니다. 혈액량이 증가할수록 양성률이 높아지므로 충분한 혈액량을 접종합니다. 소아인 경우는 2.0~4.0 mL 정도를 채혈하여 산소성배지나 상용화된 소아용배지에 접종합니다.
- 감염성 심내막염이나 카테터(catheter)관련 혈관내 감염과 관련된 지속적 균혈증 진단에는 30분~1시간 간격을 두고 혈액배양하는 것이 추천됩니다. 감염성 심내막염은 혈액배양 양성률이 90% 이상으로, 급성 심내막염인 경우 병원성이 강한 균주에 의한 것이 많으므로 즉시 혈액배양을 시행하는 것이 좋으며, 항균제 투여 전 30분 내에 채혈합니다. 아급성 심내막염인 경우는 30분~1시간 간격을 두고 채혈합니다.
- 혈액배양 검체는 정맥혈을 사용하고, 유치 혈관내 접근장치에서 채혈해야 하는 경우는 정맥채혈보다 오염률이 높으므로 말초정맥천자를 동시에 시행해야 합니다.
체액(body fluid)
-
뇌척수액(CSF)
뇌척수액 검체 채취시는 일반적으로 3개 또는 4개의 시험관에 검체를 나누어 받고, 두 번째 시험관에 받은 검체를 이용하여 그람염색과 배양을 시행합니다.
세균 배양을 위한 뇌척수액 검체는 채취 즉시 실온으로 검사실로 보내야 하며, 미생물 검체는 냉장 온도에 노출되면주요 원인균(N. menigitidis, H. influenzae)이 사멸되므로 실온보관합니다. 단, 바이러스 검사를 위한 뇌척수액 검체는 냉장보관합니다. -
기타 체액(관절액, 흉수, 복수 검체 등)
단 한 개의 집락이 자라도 의미가 있으므로 검체채취 시 오염되지 않도록 하며, 주사기로 흡인 후 무균 상태로 보관합니다.
시험관으로 옮기면 혐기성세균이 사멸할 수 있으므로 주의를 요합니다.
객담(sputum)
-
객담은 폐렴의 원인균을 검출하는 데 일차적으로 이용되며, 아침 일찍 식사하기 전에 입안을 물로 헹구고 깊은 기침을 하여 5~10 mL를 받습니다. 객담을 받을 수 없는 소아환자는 흡인으로 채취합니다.
-

입안을 맑은 물로 세척합니다.
-
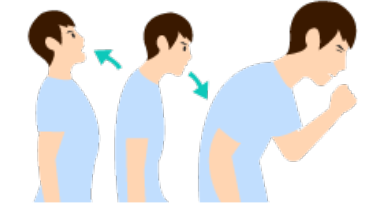
심호흡을 3회 실시하여 폐 깊숙이 있는
가래가 나올 수 있도록 합니다. -
깊은 기침을 하여 객담을 받으며
침이 섞이지 않도록 주의합니다.
-
- 검체는 채취 후 즉시 검사실로 운반하며, 지연될 경우에는 냉장 보관해야 합니다.
- 침이 많이 섞이면 구강 내 상재균이 많이 포함되어 정확한 결과를 얻기 힘드므로, 검사실에서 객담도말 표본을 그람 염색 하여 100배 시야에서 상피세포와 백혈구를 관찰하여 객담의 품질을 판정합니다. Murray와 Washington 변법에서는 두 가지 세포 수의 비율에 따라 6개의 군으로 나누며, 객담의 품질 등급에 의해 4~6등급은 수용되며, 1~3등급은 부적합 검체로 판정합니다.
객담의 품질 등급 (grade of sputum quality)
| Grade | Number of cell / Low-power field | |
|---|---|---|
| Epithelial cell | WBC | |
| 1 | > 25 | < 10 |
| 2 | > 25 | 10~25 |
| 3 | > 25 | > 25 |
| 4 | 10~25 | > 25 |
| 5 | < 10 | > 25 |
| 6 | < 10 | < 10 |
- Acceptable sputum: Grade 4, 5, 6
- Unacceptable sputum: Grade 1, 2, 3
분변(stool)
- 분변에 혈액, 점액이 섞여 있는 부분을 선택적으로 약 1~2g 정도를 채취합니다.
- 변을 채취할 수 없을 때는 면봉을 항문 괄약근 1인치 정도까지 넣어 부드럽게 회전시켜 검체를 얻은 후, 수송배지에 넣어 보관합니다.
- 장염세균을 검사하기에 가장 좋은 검체는 급성기에 채취한 설사변으로 검체 유출로 인한 오염 가능성이 있으므로 완전하게 밀봉합니다.
- 입원 3일 이후 환자의 변 배양은 권장하지 않습니다.
- 장티푸스균의 분리는 감염 후 2~3주의 변에서 2~3회 반복하여 검사할 경우 양성률을 높일 수 있습니다.
- 설사 증세를 보이면서 항균제 사용력이 있는 연령 6개월 이상의 모든 환자에 대하여 C. difficile toxin 검출을 위해 액상이거나 부드러운 변을 용기에 받아 C. difficile toxin 검사를 시행합니다(면봉 검체는 적합하지 않습니다).
- 직장도말 검사로 성매개감염(sexually transmitted disease, STD)를 위한 검체는 실온에 보관합니다.
- 바륨 관장을 한 대변으로는 검사하지 않습니다.
요(urine)
- 아침 첫 요가 가장 적합하며, 세균배양을 하기 위해서는 환자의 요도 주위를 잘 소독한 후 처음 몇 mL을 버리고 중간뇨 10.0mL 정도를 무균적으로 채취합니다.
- 카테터 요는 소변을 볼 수 없는 환자나 무균 조작이 반드시 필요한 환자에서만 시행합니다.
- 혐기성 배양 시 치골 결합부에서의 흡인뇨(suprapubic aspiration)를 무균적으로 채취합니다.
- 항산성균 배양 시 아침 첫 요를 계속해서 3~5일간 채취하는 것을 원칙으로 합니다.
-
반드시 멸균용기에 채취한 후 30분 이내에 보내야 하며, 부득이한 경우에는 반드시 냉장 보관하고 채취 시간을 기록합니다.
Neisseria 균속이 의심되는 검체는 30℃ 이하로 내려가면 사멸하므로 실온이나 37℃에 보관합니다.
농(pus)
- 주사기로 흡입한 농성 검체나, 흡입할 수 없는 경우 병변의 깊은 부위에서 채취한 2개의 면봉을 수송배지에 넣어 보냅니다. 혐기성 배양을 위해서는 추가로 면봉검체가 필요하며 혐기성 조건으로 운반하고 신속하게 배양합니다.
생식기 검체
-
여성 생식기
자궁경관에서는 질 내의 세균이 오염되지 않게 하면서, 윤활제를 쓰지 않고 질경(speculum)을 이용하여 자궁경부를 보이게 한 다음 면봉으로 점액을 제거한 후 새로운 면봉을 사용하여 자궁경부내강(endocervical canal)에 넣어 검체를 채취 후 수송배지에 넣습니다.
-
남성 생식기
요도 검체는 분비물이 많을 때는 면봉으로 채취하고, 적을 때는 요도의 2cm 깊이까지 가느다란 면봉을 넣어 채취 후 수송배지에 넣습니다.
- 골반 염증성 질환(pelvic inflammatory) 진단에는 흡인 검체가 좋습니다.
조직(tissue)
조직 검체는 멸균용기에 멸균식염수를 넣거나 멸균식염수를 적신 거즈로 싸서 마르지 않게 검사실로 보냅니다.
혐기성 세균 배양을 위한 검체
- 혐기성 세균은 공기에 노출되면 사멸되기 쉬우므로 검체의 수송 및 채취가 중요하며, 산소에 노출되는 것을 막기 위해서는 CO2나 N2 가스를 채운 시험관이나 병 등을 사용합니다.
- 흡인했을 때는 주사기에서 공기를 배출시킨 후, 마개로 막고 즉시 검사실로 보냅니다. 혐기성세균이 정상 상재균으로 존재하는 검체(객담, 요, 대변, 인두액 등) 는 혐기성 배양을 하지 않고, 주로 체액, 농, 경기관 흡인액, 생검 조직 및 혈액 등을 대상으로 합니다.
Urea breath test (helifinder)
-

①
-

②
-

③
-

④
- 요소 복용 전 코로 숨을 들이키고 입으로 내뱉어 흰색 튜브에 1차 호기를 채취합니다.
- 공복상태에서 물 약 50 mL~100 mL와 함께 요소 캅셀을 복용합니다.
- 앉은 상태로 약 20분 가량 기다립니다. 이 때 껌, 사탕, 흡연을 삼가해 주시기 바랍니다(부정확한 결과가 나올 수 있습니다).
- 1번과 동일한 방법으로 2차 호흡샘플(청색 튜브)을 채취하도록 합니다.
- 임산부 및 임신하고 있을 가능성이 있는 가임여성, 약성분에 대한 과민반응의 기왕력이 있었던 환자에게는 투여하지않 습니다.
- 동봉된 빨대는 날숨 채취용으로만 사용합니다.
- 검사를 실시하기 전 최소 2~4시간 이상 금식해야 합니다. 환자는 검사 실시 전 4주 이내 Helicobacter pylori를 억제하는 것으로 알려져 있는 항생제, 프로톤 펌프저해제, bismuth제제를 복용한 이력이 없어야 합니다.
바이러스 검사
- 바이러스 배양법은 원인 바이러스가 자랄 수 있는 가장 특이한 세포를 사용하므로 검체는 감염 병소에서 채취합니다.
- 일반적으로 질병 경과가 길수록 바이러스 검출률은 낮아지므로, 바이러스 농도가 높은 감염 초기에 채취하는 것이 좋습니다.
- 바이러스 운송 배지(VTM)에는 세균의 증식을 억제하는 성분이 함유되어 있으며, 채취 즉시 검사실로 보내어 검사를 해야 하나, 만약 그렇지 못한 경우에는 2~3일 이내에 검사가 이루어져야 합니다.
- 장기간 보관 시에는 -70℃에 냉동 보관하며, 반복 해동 시 바이러스 역가가 감소할 수 있습니다. 단, CMV나 RSV 분리를 위한 검체는 냉동보관을 피해야 합니다.
- 전혈검체는 토요일 및 공휴일 전날 검체 접수를 삼가하여 주시기 바랍니다.
- 일반적으로 급성호흡기 증상을 나타낸 지 5일 이내에 검체를 얻는 것이 좋고, 48시간 내에 얻은 검체가 이상적입니다.
바이러스 배양검사 검체별 안내
| 검체종류 |
채취 및 검체량 |
검체용기 | 주의사항 |
|---|---|---|---|
| Stool | 3~5g (설사변일 경우 5g) | 멸균용기 |
|
| Urine | 5.0mL (신생아: 2.0~3.0mL) | CMV 배양의 경우 VTM 용기 사용 | |
| CSF | 3.0~5.0mL | 혈액이 혼입된 검체는 혈액 내에 존재하는 항체가 바이러스 배양을 억제 | |
| Rectal swab | 면봉을 직장 내 2~4cm 부위에서 rub and rotation 방법으로 채취 | VTM | 대변을 채취하지 못할 경우 사용 |
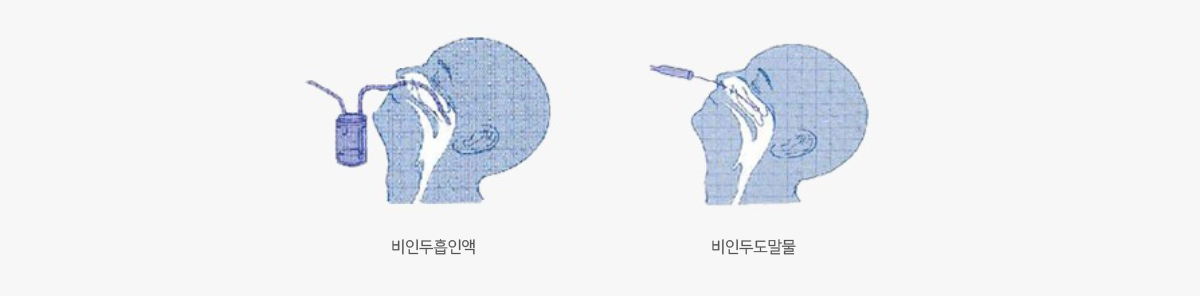
| 상부호흡기 |
① 비인두흡입물 ② 비인두도말물 ③ 구인두도말물 바이러스 분리율 ① > ② > ③ |
|
|
| 하부호흡기 | 기관지흡입물 기관지세척액 |
|
|
| Skin, Mucous membrane lesion | 수포(vesicle)를 26 gauge 주사침이나 tuberculin syringe 또는 면봉을 사용하여 채취 |
|
|
| Eye |
결막
|
운송배지에 사용된 면봉 모두를 넣음. | |
| Cervical urethral | 면봉검체 사용 | - | |
| 타액 | 2.0~3.0mL | - | |
| Semen | - | CMV 배양에 주로 이용 | |
| Blood | 전혈 5.0~8.0mL |
Heparin, Sod. Citrate |
- |
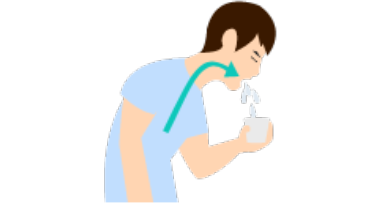
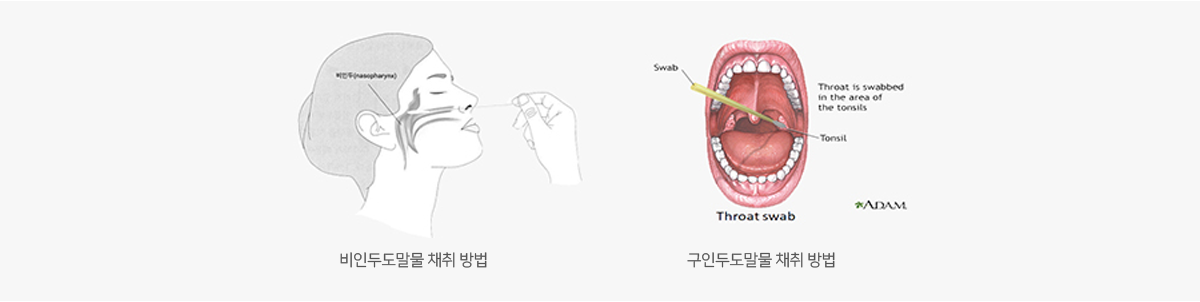
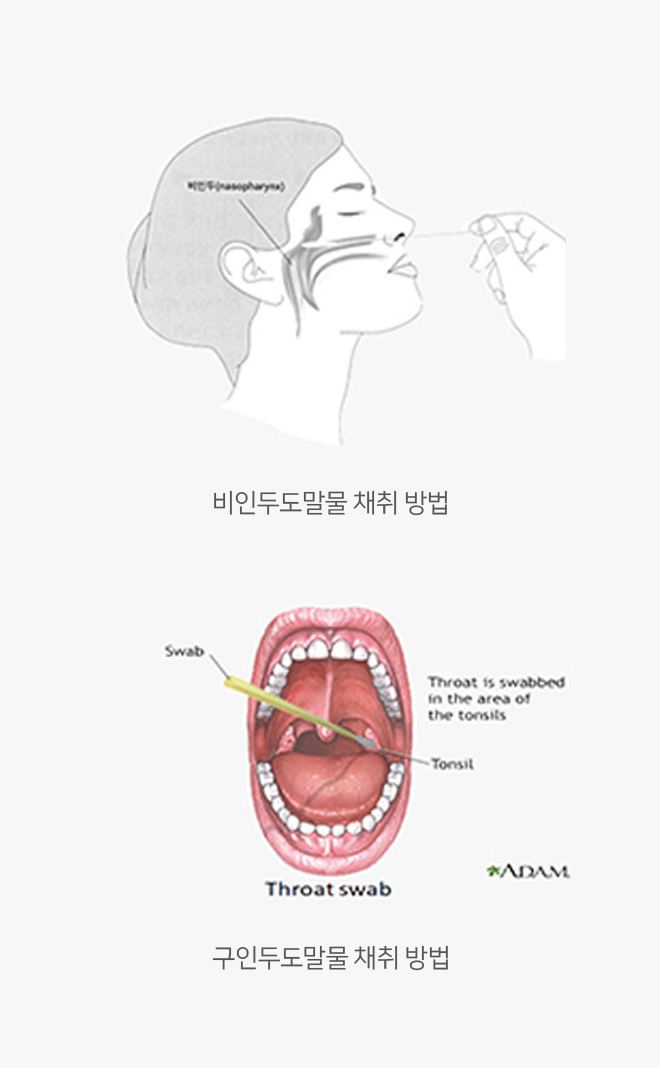
비인두도말물 & 비인두흡인액(nasopharyngeal swab & nasopharyngeal aspirate)
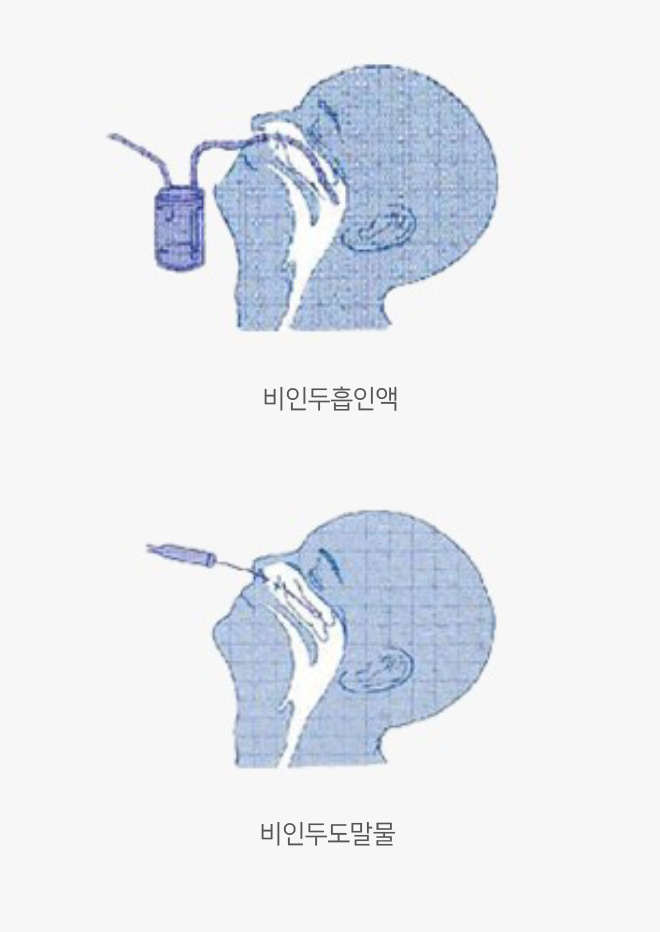
- 비인두도말 시 멸균면봉을 하비갑개의 중하부 근처에서 점막을 부드럽게 3~4회 돌려서 채취합니다.
- 비강흡인물 채취 시에는 비강을 통하여 카테터 끝이 인두 후벽까지 다다르게 한 다음 진공흡입을 걸고 카테터를 약간씩 돌리며 천천히 부드럽게 빼내면 됩니다. 진공흡입 후 카테터가 비인두부에 10초 이상 길게 머물지 않도록 주의합니다.
- 카테터를 멸균 생리식염수(약 1.0mL)로 세척하여 무균용기에 담습니다.
- 비인두흡인액 3~5 mL을 무균용기에 넣고, 비인두도말물은 VTM 용기에 넣어 4℃ 냉장 상태에서 보관 후 운송(운송 시 내부온도 4℃ 유지) 합니다.
구인두도말물(oropharyngeal swab)
- 환자의 입을 벌리고 반드시 "아-"하는 소리를 실제로 내게 합니다.
- 왼손으로 설압자를 잡고 설압자로 혀를 누릅니다.
-
오른손에 멸균면봉을 잡고 인두 후벽을 면봉으로360°로 3~4회 돌려 도말합니다.
이때 환자 목젖을 건드리면 환자가 구역질을 하게 되므로 목젖을 피해서 도말을 합니다. - 채취한 구인두도말물은 VTM 용기에 넣어 4℃ 냉장 상태에서 보관 후 운송(운송 시 내부온도 4℃ 유지) 합니다.
유전자검사 동의서
-
「생명윤리 및 안전에 관한 법률」 제51조제1항 및 제3항에 의거하여 유전자검사기관에 유전자검사를 의뢰할 때에는 검사대상자(또는 법정 대리인)로부터 소정의 서면동의를 받도록 규정하고 있습니다.
-
유전자검사기관 외의 자가 검사대상물을 채취하여 유전자 검사기관에 유전자검사를 의뢰하는 경우에는 제1항에 따라 검사대상자로부터 서면동의를 받아 첨부하여야 하며, 보건복지부령으로 정하는 바에 따라 개인정보를 보호하기 위한 조치를 하여야 한다.
(「생명윤리 및 안전에 관한 법률」제51조제3항) -
유전자검사기관 외의 자가 유전자검사기관에 유전자검사를 의뢰할 때에는 제3항에 따른 동의서에서 성명, 생년월일 등 검사대상자 개인을 식별할 수 있는 사항을 익명화해야 한다.
(「생명윤리 및 안전에 관한 법률 시행규칙」 제51조제4항) -
제51조제1항부터 제4항까지의 규정을 위반하였을 경우, 제56조제1항에 의거 1년 이내의 업무정지 등의 행정처분 또는 제68조에 의거 1년 이하의 징역 또는 2천만원 이하의 벌금에 처한다 .
(「생명윤리 및 안전에 관한 법률」 제56조제1항 및 제68조)
-
유전자검사기관 외의 자가 검사대상물을 채취하여 유전자 검사기관에 유전자검사를 의뢰하는 경우에는 제1항에 따라 검사대상자로부터 서면동의를 받아 첨부하여야 하며, 보건복지부령으로 정하는 바에 따라 개인정보를 보호하기 위한 조치를 하여야 한다.
- 유전자검사 의뢰 시 유전자검사 동의서가 첨부되지 않은 검사에 대해서는 처벌의 대상이 되므로 검사를 시행할 수 없으며, 유전자검사 동의서에 검사대상자의 성명, 생년월일, 전화번호 등 개인식별정보를 익명화하여 첨부하여 주시기 바랍니다.
- 본원에서 시행하는 유전자검사뿐만 아니라 재위탁하는 유전자검사도 검사대상자의 서면동의서를 반드시 첨부하여 주시기 바랍니다.
세포유전
- 검체는 무균적으로 채취하며 보관 및 운송은 실온 상태로 합니다.
- 검체 채취부터 배양까지 24시간 이내에 진행될 수 있도록 운송하며, 24시간 이내의 경우 세포분열능이 좋아 검사 소요일 내 보고율이 높으며, 24시간 이상일 경우 냉장 보관합니다.
- 세포유전 검사의뢰서 또는 세포유전 검사의뢰서(혈액종양), 유전자검사 동의서를 기재하여 검체와 함께 의뢰합니다.
- 태아를 대상으로 하는 염색체 검사는 검체채취 전 검사의 정확성 및 검사한계에 대해 환자나 보호자에게 충분히 설명을 하여 동의를 얻은 후에 검사를 시행하는 것이 바람직합니다.
검체별 채취 방법
말초혈액(peripheral blood, PB)
- Sodium heparin 용기에 혈액 5.0mL(소아 3.0mL)을 무균적으로 채취합니다. 응고된 검체는 검사가 불가능하며 sodium heparin 이외의 항응고제는 세포분열능 저하로 인하여 배양 실패 확률이 높습니다.
- 환자의 임상소견 및 추정 진단에 따라 검사방법 자체가 달라지므로 반드시 의뢰서에 소견 및 진단명을 기재합니다.
골수(bone marrow, BM)
- 본원에서 제공하는 전용 운송용 배지 또는 sodium heparin 용기에 골수를 무균적으로 채취하며, 응고된 검체는 검사가 불가능합니다.
- 환자의 임상소견 및 추정 진단에 따라 검사방법 자체가 달라지므로 반드시 의뢰서에 소견 및 진단명을 기재합니다.
- 혈액종양에서는 세포 배양 시 혈액검사(CBC) 결과를 고려해서 적절한 세포 수가 되도록 배양해야 하므로 귀 원에서 시행한 CBC 결과를 기재하거나 첨부하여 보냅니다.
양수(amniotic fluid, AF)
- 검체에 모체세포가 혼입되는 것을 방지하기 위해 채취 시 처음의 소량(약 2.0mL 정도)은 반드시 버린 다음 약 20.0~30.0mL 정도의 양수를 채취하여 무균용기(50.0mL 용)로 옮겨 의뢰합니다.
- 혈액이 혼입되어 육안적으로 양수의 색깔이 붉거나 짙은 갈색의 경우 또는 양수 내 태아 유래 세포가 적은 경우(원심 후 침전물이 육안으로 확인이 안되는 경우)는 결과 지연 및 배양 실패의 원인이 됩니다.
태아조직(production of conceptus, POC)
- 태아조직의 경우 오염될 확률이 매우 높아 주의가 필요합니다.
- 무균적으로 채취하며, 성공적인 배양을 위해 융모막(chorionic villi)을 포함한 조직을 본원에서 제공하는 전용 운송용 배지에 넣어 의뢰합니다.
- 자궁 내에서 사망한지 24시간 이상이 경과한 검체는 배양에 실패할 확률이 높습니다.
융모막(chorionic villi sampling, CVS)
- 융모막 20~40mg을 채취하여 본원에서 제공하는 융모막 전용 운송용 배지에 넣어 의뢰합니다.
- Zoom-stereo microscope으로 관찰하여 순수한 융모막으로 검사를 시행합니다.
- 융모막의 양이 충분할 경우 In situ (직접법)와 플라스크 방법을 병행합니다.
- 융모막의 양이 적을 경우 플라스크 방법만을 시행하기 때문에 모체 세포의 오염 가능성이 높아지고 결과가 지연되거나 혹은 배양에 실패할 수도 있습니다.
제대혈(cord blood)
제대혈(cord blood) 검체는 응고가 잘되므로 채취 후 sodium heparin 용기에 넣어 즉시 여러 번 혼합하여 의뢰합니다.
분자유전
- 분자진단검사에서 가장 중요한 것은 적절한 검체와 오염의 방지입니다.
- 모든 혈액 및 골수를 이용하여 PCR 검사를 의뢰하고자 할 경우 원칙적으로 모든 검체는 EDTA blood를 사용합니다. 항응고제 중 헤파린은 Taq. polymerase의 활성화를 억제하여 검사가 불가능합니다.
- 조직을 의뢰하는 경우는 포르말린 고정 없이 멸균 생리식염수에 넣어 의뢰합니다.
-
다른 검사와 동시 의뢰된 검체는 PCR 전용용기에 따로 구분하여 보내며 멸균용기를 사용합니다.
Hepatitis virus 관련 검사는 SST 사용을 원칙으로 합니다.
Human papilloma virus 관련 검사는 반드시 각 종목에 해당되는 전용용기를 사용합니다.
- 용혈 시에는 혈장 또는 혈청에 hemin이 혼입되어 DNA 중합효소를 억제할 수 있어 핵산분석에 영향을 미치므로 주의합니다.
- 세균이나 바이러스 등 미생물의 DNA나 RNA 추출은 질병의 상태에 따라 적절한 시기와 검체를 선택하는 것이 중요하고, 핵산이 온전하게 유지될 수 있도록 하여야하며 다른 미생물의 오염이나 인체 세포가 섞이는 것을 방지해야 합니다.
- 유전질환이나 기타 신중을 요하는 검사는 반드시 분자유전 검사의뢰서 또는 분자병리 검사의뢰서 M, 유전자검사 동의서를 첨부합니다.
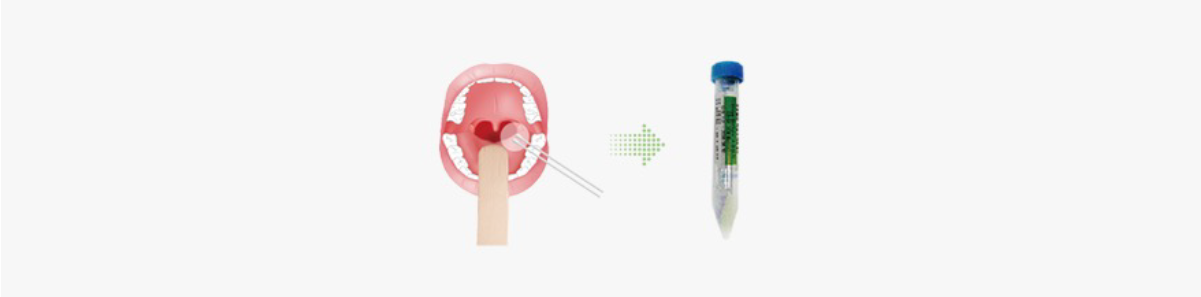
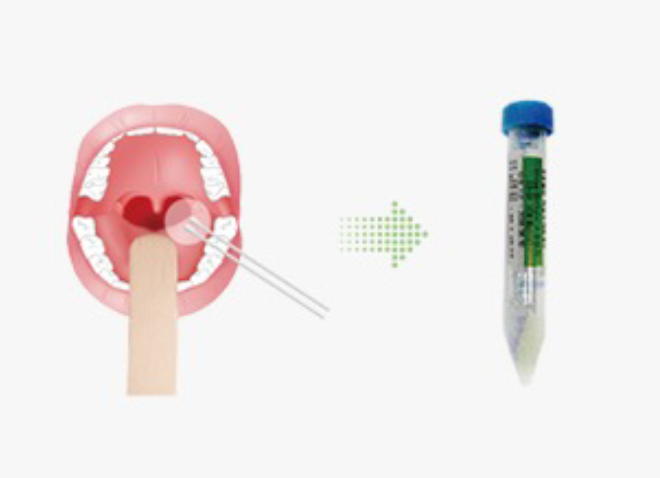
코로나바이러스감염증-19 (SARS-CoV-2) 검사
- 선별진료소 또는 의료기관 내 다른 공간과 격리된 검체 채취 공간에서 검체를 채취합니다. 검체 채취 시 KF94 또는 동급 이상의 호흡기보호구, 일회용 장갑, 일회용 방수성 긴팔가운, 고글 또는 안면보호구(필요시 불투과성 일회용 앞치마 추가 착용) 등의 개인 보호구 착용 및 검체 채취 후 소독이 필수적으로 시행되어야 합니다.
- 상기도검체는 비인두도말물(nasopharyngeal swab)이 권장되며, 비인두도말물 채취가 어려운 경우 구인두도말물(oropharyngeal swab)로 대체할 수 있습니다. 경증인 경우 상기도 검체만 채취하고, 가래가 있는 환자의 경우 하기도 검체로 검사의뢰가 가능합니다.
- 비인두도말물은 콧구멍을 지나 입천장과 평행한 각도로 면봉을 밀어넣고 하비갑개 중하부에서 분비물을 긁어서 채취하며, 하비갑 개 중하부에서 몇 초간 분비물을 흡수할 수 있는 시간을 두도록 합니다. 구인두도말물은 뺨 안쪽, 혀 뿌리 등이 아닌, 혀를 누르고 편도 주변 인두후벽에서 분비물을 긁어서 채취하되, 분비물을 충분히 흡수하여 채취합니다.
-
검체 채취 후 수송배지가 담긴 병에 도말한 면봉을 담그고 병마개 부위에서 면봉을 부러뜨린 후 뚜껑을 단단히 잠그도록 합니다. 부러뜨릴 때 안쪽에 손이 닿아 오염되지 않도록 주의하고, 검체가 담긴 병은 즉시 냉장(4℃) 보관합니다.
-
하기도검체인 가래(sputum)는 가래가 있는 환자에서 채취하며, 에어로졸 발생 가능성이 있으므로 가래 유도는 금지합니다. 정확한 진단을 위해 가래 채취가 반드시 필요한 경우에는 음압실에서 채취해야 하며, 음압시설이 없는 경우 외부 환기가 잘 되는 독립된 공간에서 채취합니다. 환자 스스로 구강 내를 깨끗한 물로 세척한 후, 멸균용기(가래통 등)에 타액 등이 포함되지 않도록 깊이 기침하여 채취합니다.
-
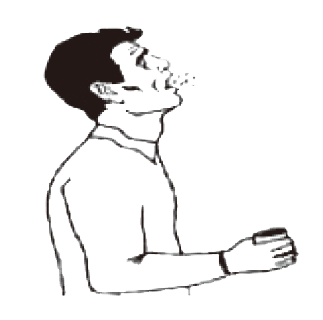
① 구강세척
-

② 무균용기 사용
-

③ 기침 유도하여 객담채취
-

④ 완전밀봉(4℃ 유지)
-
- 채취용기에 환자의 인적사항(성명, 성별, 연령) 및 채취일을 기입하고, 감염성물질 안전수송 지침에 따라 전용용기에 3중 안전 포장 후 냉장(4℃) 상태를 유지하여 의뢰합니다.
[출처: 중앙방역대책본부ㆍ중앙사고수습본부 / 코로나바이러스감염증-19 대응 지침(지자체용) 제 13-3판]

