검체 채취
실시간 모니터링이 가능한 검체운송시스템으로
검체 안정성을 최적화합니다.
채취 시기
식이 영향을 받는 혈당이나 중성지방검사, 일중변동이 있는 호르몬검사, 투약시간이 중요한 약물검사 등은 검체 채취 시각을 정확히 지켜야 합니다. 연속적 심혈관표지자와 같이 치료 후 시간에 따른 변화를 확인하려 할 경우에는 일정 시간 간격으로 검체를 채취합니다.
검사결과에 영향을 미치는 생리적 변동 요인
-
개인 간 변동
- 유전 : 개인차, 성별, 인종
- 생활환경 : 지역, 식습관, 흡연, 직업
- 시간 : 연령
-
개인 내 변동

- 시간 : 일중변동, 일간변동, 계절에 따른 변동
- 행동 : 식사, 체위, 운동
- 생리 : 검체채취 부위, 성주기, 임신
식후 측정치가 변동하는 검사항목
-
증가

요량, 요당, 혈당, Triglyceride, Uric acid, Lipoprotein (LDL, VLDL), Amylase, Total lipid, Catecholamine, Insulin, Aldosterone, VMA, Vitamin
-
감소

Glucose를 제외한 요 중 성분 농도, Hemoglobin, Hematocrit, WBC count, Total protein, Albumin, Serum iron, Growth hormone
운동 후 측정치가 변동하는 검사항목
-
증가
Blood cell, Hematocrit, Hemoglobin, Total protein, Lactic acid, Triglyceride, Free fatty acid, AST, ALT, LDH, CK,Growth hormone, Sodium, Chloride, Whole blood specific gravity, Urine RBC, Urine urobilinogen
-
감소

Amino acid in blood, Renal clearance, Potassium, GTT, Urine calcium, Magnesium
채취 준비
환자 준비사항 및 인적사항 확인(patient identification)
- 채혈하기 전 환자에게 채혈할 것을 충분히 설명해야 합니다.
- 환자 이름, 생년월일, 병원 등록번호, 성별 등 반드시 2개 이상의 개방형 질문을 통해 환자 확인을 철저히 합니다.
- 의식이 없거나 너무 어린아이, 인지장애 환자의 경우 반드시 간호사, 보호자, 동반자 등을 찾아서 환자 정보를 확인하며, 주어진 환자 정보와 가지고 있는 환자 정보를 비교해야 합니다.
- 채혈하고자 하는 환자의 손목/발목 띠 또는 검사의뢰서를 반드시 확인합니다.
- 환자 확인 과정에서 문제 발생 시 채혈을 보류합니다.
검체 라벨링 부착 및 확인
- 검체용기에는 적어도 2개의 식별자가 라벨링이 되어 있어야 합니다.
- 환자 정보와 바코드 정보를 확인 후 검체용기에 바코드가 떨어지지 않도록 완전 밀착하여 부착하며, 구겨지거나 파손된 바코드는 자동화 분석이 불가능하므로 사용하지 않습니다.
- 검체가 2개 이상인 경우 바코드를 검체 수만큼 출력하여 각각의 검체용기에 바코드를 부착해야 합니다.
- 채취 부위 또는 채취 시간이 다른 동일 종류의 검체로 동일 종목의 검사를 의뢰할 경우에는 각각 서로 다른 바코드를 부착해야 합니다. 바코드가 동일하면 각각 독립된 작업번호가 부여되지 않아 제대로 검사가 될 수 없습니다.
- 튜브 형태의 검체용기는 바코드 리더기가 읽기 용이하도록 세로 형식으로 부착하며, 검체 상태와 검체량 확인이 가능하도록 바코드를 부착합니다.
- 채혈하고자 하는 환자와 부착된 검체 바코드의 환자 이름, 병원 등록번호 등을 비교하여 다시 한번 확인 후 채혈을 합니다.
바코드 부착법
-

올바른 바코드 부착법
-

다수 검체 바코드 부착법
-

다수 바코드 부착법
채취 방법
혈액채취방법은 정맥천자가 가장 흔하며 그 외에 동맥, 피부천자와 중심정맥접근장치를 이용한 채혈법 등이 있습니다. 모세혈관은 정맥혈관이 좋지 않은 경우나 소아에서 사용할 수 있으며, 환자가 수액을 맞고 있는 쪽은 피하도록 합니다. 혈액의 농축 및 용혈로 인한 검사결과 변동을 최소화하기 위해 압박대를 1분 이상 묶지 않은 상태에서 적당한 속도로 거품이 발생하지 않게 채혈합니다. 채혈부위가 손이나 발인 경우 또는 아동에서는 나비바늘 주사기를 이용하는 것이 도움이 됩니다. 피부천자는 주로 소아, 특히 신생아에게 사용하는 방법으로, 신생아부터 12개월까지는 발뒤꿈치를, 12개월 이후부터는 2~4번째 손가락을 이용하여 피부천자를 시행합니다. 동맥천자 시 노동맥이 곁순환이 있고 위팔동맥보다 신경에서 멀고, 대퇴동맥보다 감염의 위험이 적기 때문에 우선적으로 천자합니다.
용혈에 의한 검사결과의 변동
-
증가
Total protein, A/G ratio, Potassium, Chloride, Inorganic phosphorus, Iron, Amylase, AST, ALT, LDH, Cholesterol
-
감소

Bilirubin, Lipase, ACP
검사 용도별 채취 순서
검사 용도별 검체를 확인하여 정해진 검체용기의 사용과 용량을 준수하고, 여러 종류의 튜브가 요구될 경우에는 권장 순서에 따라 채혈합니다.
권장 채취 순서
-

01Blood culture
bottle -

02Sodium-citrate
tube -

03Plain tube &
SST -

04Heparin tube
-

05EDTA tube
-

06NaF tube
채취 도구 폐기
- 채혈에 사용한 주사바늘은 의료폐기물 중 손상성폐기물로 전용용기에 폐기하여야 합니다.
- 전용용기인 바늘 수거통의 입구를 눈으로 확인할 수 있는 정도로 위치시킵니다.
- 주사바늘을 직접 건드리지 않고 제거할 수 있는 전용용기의 홈을 이용하여 바늘이 위로 나오지 않게 폐기합니다.
- 주사바늘의 뚜껑을 다시 닫는 행위, 억지로 구부리거나 부러뜨리는 행위, 일회용 주사기에서 빼거나 혹은 다른 손으로 만지는 행위를 해서는 안됩니다.

검체 원심분리
- 혈청(Serum) 혹은 혈장(Plasma)은 전혈을 원심분리하여 얻을 수 있습니다.
- 항응고제나 응고촉진제가 포함된 용기를 사용하는 경우 채혈 후 잘 섞이도록 전도 혼합 합니다.
- 혈청 원심분리하기 전에 응고가 잘 일어나도록 실온에서 약 15~30분 가량 보관하여야 후기섬유소 형성에 의한 영향을 최소화 할 수 있습니다
- 일반화학용 검체는 채혈 후 2시간 이내 원심분리를 시행해야 합니다. 원심분리가 지연되는 경우 실온 보관을 권장합니다(냉장 보관 시 발생할 수 있는 용혈 방지).
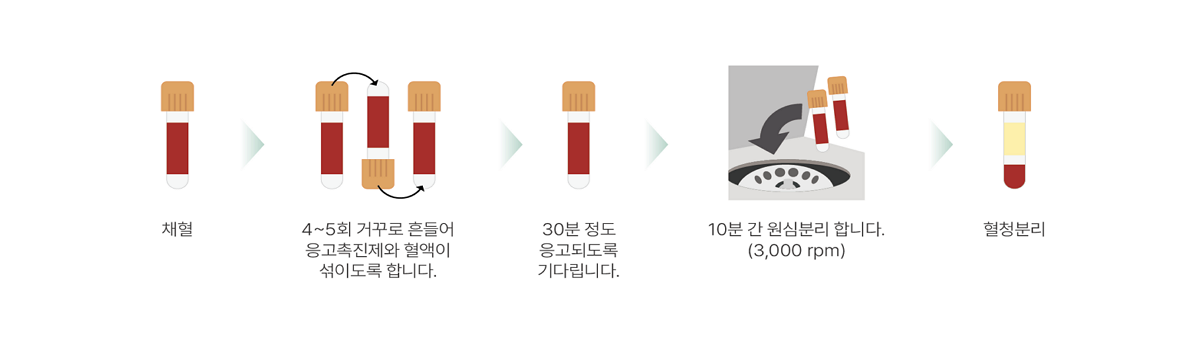
- 당일 검사가 불가능한 검체는 혈청 또는 혈장을 분리한 후, 검사 항목에 적합한 보관 조건(냉장(2~8℃) 또는 냉동 ( -20℃))에 따라 보관해야 합니다.
- 항응고제와 혈액량의 비율이 적합하지 않으면 미세한 혈액응집이 생겨 혈구계산검사 또는 혈액응고검사에 오차가 생길 수 있으며 자동화장비에 장애를 일으킬 수 있습니다.
- 혈액응고검사를 위한 채혈 시 조직액이 미량 섞이거나 항응고제 비율이 적당하지 않으면 환자 상태와 전혀 다른 결과를 초래할 수 있으므로 주의가 필요합니다.
- 혈당검사 의뢰 시 채혈 후 NaF 용기 사용을 권장하며, 30분 이내에 혈청분리를 실행하여야 합니다.
- 중금속검사 의뢰 시 채혈 후 중금속 전용용기를 사용해야 합니다. 전용용기는 혈청 용기와 EDTA 용기를 구분하여 채혈해야 하며, 채혈 후 첨가제와 잘 혼합될 수 있도록 8~10회 전도 혼합을 합니다. 혈청 검체의 경우 채혈 후 용혈 방지를 위해 분리가 필요합니다. 피브린 생성 방지를 위해 최소 30분~60분 실온 방치 후 원심분리를 하며 피브린 제거를 위해 목면봉 또는 어플리케이터를 사용하지 않아야 합니다.
채취 방법
일반 요검사를 위한 단회뇨(random urine, RU)
아침 첫 요의 중간뇨는 하루 중 가장 농축된 상태이며, 산성이 강해서 원주(casts)나 기타 요 구성물이 잘 유지되므로 일반 요검사나 현미경적 검사에 가장 적합합니다. 채취 시, 처음과 마지막에 나오는 소변은 버리고 중간뇨 30~60 mL 가량을 깨끗하고 건조된 용기에 받습니다. 반드시 식후 2시간 이상 경과된 후, 심한 운동을 하지 않은 상태에서 채뇨합니다. 검사 의뢰 전까지 냉장 보관합니다.
정량검사를 위한 24시간 축뇨(24 hours urine, 24hU)
하루 중 그 배설이 일정치 않은 호르몬, 단백 및 전해질 등을 정량하고자 할 때에는 24시간 축뇨가 필요합니다. 지정된 시간(예: 오전 8:00)의 첫 요는 버려 방광을 비우고, 그 이후부터 다음날 지정된 시작 시간(오전 8:00)까지의 모든 소변을 용기에 모읍니다(대변볼 때 나오는 소변도 모아야 합니다). 보존제가 필요한 검사항목의 경우, 검체채취 전에 요 보존제를 첨가합니다. 24시간 동안 냉장 보관하면서 소변을 모으고, 만약 채뇨 중 100 mL 이상 검체가 유실된 경우에는 처음부터 다시 검체를 모읍니다. 모아진 소변은 총 축뇨량을 기입하고 잘 혼합하여 검사 시 필요량을 채취하여 검사를 의뢰합니다.
세균배양을 위한 채뇨
청결채취중간뇨(clean-catch midstream urine)가 적절하나, 필요 시에는 직접 채취 카테터뇨, 치골상부흡인뇨 등이 이용되며 채취 시에는 질, 회음부, 요도 상재균의 오염을 방지하는 것이 중요합니다. 청결채취중간뇨는 가장 간편하게 이용되며, 오염방지를 위해 비눗물로 요도 주위를 닦고 비눗물을 잘 씻어낸 뒤 배뇨하여 중간뇨를 무균용기에 받습니다. 치골상부흡인뇨는 요를 받기 어려운 영유아 등 소아과 환아나 임산부에서 시행되며 오염되지 않은 검체를 채취할 수 있습니다. 직접 채취 카테터뇨(straight catheterized urine)는 방광에서 오염되지 않은 요검체를 채취할 수 있으나 요도에 있던 미생물이 카테터로 인해 방광으로 들어갈수 있으므로 주의하여 채취합니다. 유치 도뇨관이 있는 환자의 요배양은 세심한 무균조작하에 주사기로 흡인검체를 채취합니다. 요검체는 즉시 냉장보관하며 냉장보관 시 24시간 동안 검체의 세균 수를 유지할 수 있습니다.
요 보존 방법
세균 번식을 막고 용질, 세포, 원주 등의 변성을 방지하기 위해 보존하는 방법으로는 냉장 또는 냉동, pH 조절, 화학 보존제 첨가 등이 있습니다.
냉장 또는 냉동 보관
요검사가 지연될 때는 요검체를 냉장 보관 하여야 합니다. 특히 요보존제 사용에 따른 영향을 방지할 필요가 있을 때 사용합니다. 불안정한 물질의 정량검사를 실시할 때는 24시간 뇨의 일부를 냉동시켜 보관합니다.
화학 보존제
24시간 축뇨를 이용한 검사의 가장 큰 오차의 원인은 검체채취 및 보존상의 오차이므로 검사결과에 영향을 미칠 수 있는 음식이나 약물 복용을 금하고 검사 종목에 따른 보관방법과 요보존제를 첨가합니다.
항목별 24시간뇨 보존제
| GC Labs 코드 | 검사명 | 보존제 종류 | 비고 |
|---|---|---|---|
| C435 | 17-KS | 6N HCl (또는 무방부제) | |
| C436 | 17-OHCS | 6N HCl (또는 무방부제) | |
| C438 | 5-HIAA [24hU, LC-MS/MS] | 6N HCl | |
| C441 | Al (aluminum) | 무방부제 | |
| P579 | Albumin [24hU] | 무방부제 | |
| E467 | Aldosterone (24hU) | 무방부제 | |
| C474 | BUN (U) | 무방부제 | |
| C475 | Calcium (U) | 6N HCl 5 mL 첨가 | |
| D711 | cAMP (cyclic adenosine monophosphate) [24hU] | 무방부제 | |
| N593 | Catecholamines, free, 2분획 [24hU, LC/MS-MS] | 6N HCl | |
| N596 | Catecholamines, free, 3분획 [24hU, LC/MS-MS] | 6N HCl | |
| C201 | Ccr (creatinine clearance) | 무방부제 | |
| C442 | Cd (cadmium) | 무방부제 | |
| C505 | Citric acid (citrate, U) | 6N HCl (또는 무방부제) | |
| C480 | Cl (U) | 무방부제 | |
| B593 | Co (cobalt) | 무방부제 | |
| U131 | Coproporphyrin (정량) | 10% sodium carbonate 15~20 mL 첨가(알칼리 상태 유지) | 차광 |
| L961 | Cortisol, free (CIA) | 무방부제 | |
| P300 | C-peptide [24h U] | 무방부제 | |
| C444 | Cr (chromium) | 무방부제 | |
| E605 | Creatine (U) | 무방부제 | |
| C476 | Creatinine [24hU] | 무방부제 | |
| C450 | Cu (copper) [U] | 무방부제 | |
| N220 | delta-ALA | 무방부제 | |
| C181 | Free kappa light chain (U) | 무방부제 | |
| C182 | Free lambda light chain (U) | 무방부제 | |
| C477 | Glucose(U) | Glacial acetic acid 5 mL 첨가 | |
| C446 | Hg (mercury) | 무방부제 | |
| C301 | HVA [24hU, LC-MS/MS] | 6N HCl | |
| S131 | Hydroxyproline, total | 무방부제 | |
| C478 | Inorga.phosphorus(U) | HCl 첨가(pH 3.0 미만으로 유지) | |
| C481 | K (U) | 무방부제 | |
| P301 | Magnesium(Mg)[24h U] | 무방부제 | |
| GA0P | Metanephrines, 2분획 [24hU, LC-MS/MS] | 6N HCl | |
| S750 | Methylmalonic acid [24hU, GC/MS] | 6N HCl | |
| S973 | Microalbumin [24hU] | 무방부제 | |
| C449 | Mn (manganese) | 무방부제 | |
| C482 | Na (U) | 무방부제 | |
| U120 | Osmolality (U) | 무방부제 | |
| C208 | Oxalic acid (oxalate) [GC/MS] | 6N HCl | |
| C451 | Pb (Lead) | 무방부제 | |
| U123 | Porphobilinogen 정량 |
- 10% sodium carbonate: 5세 이하 15.0 mL, 성인 25.0 mL - 5 g sodium carbonate - 무방부제 |
차광 |
| K675 | Protein EP [24hU] | 무방부제 | |
| C640 | Protein, total [24hU] | 무방부제 | |
| C427 | Selectivity index | 무방부제 | |
| C479 | Uric acid (U) | NaOH 첨가(pH 8.0 초과로 유지) | |
| L043 | Urinary bromide [24hU] | 무방부제 | |
| L041 | Urinary iodine [24hU] | 무방부제 | |
| U130 | Uroporphyrin (정량) | 10% sodium carbonate 15~20 mL 첨가(알칼리 상태 유지) | 차광 |
| C434 | VMA 정량 [24hU, LC-MS/MS] | 6N HCl | |
| C459 | Zn (zinc) [U] | 무방부제 | |
| S527 | α1-Microglobulin | 무방부제 |
* 보존제가 필요한 두 가지 이상의 검사를 동시 의뢰 시 채취 전 본원으로 문의하여 주시기 바랍니다.
채취 방법
단회 분변(Stool)
2~3g의 대변을 멸균된 플라스틱 용기에 채취합니다.
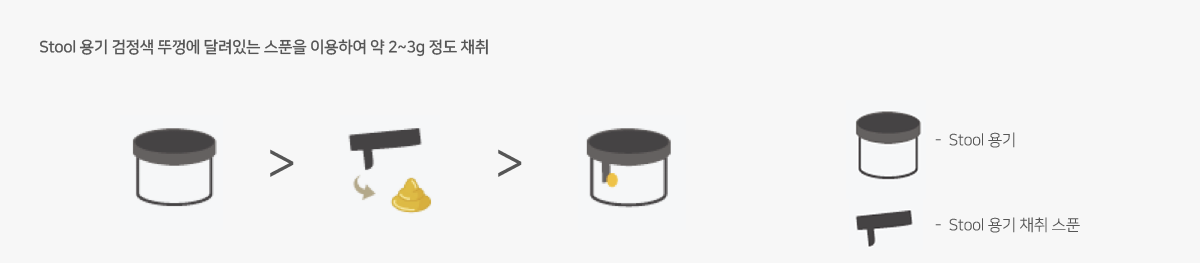

24시간 분변(24 hours stool)
채취한 검체의 총 무게를 측정한 후 검체 내용물을 균등하게 혼합합니다. 멸균된 플라스틱 용기에 검사에 필요한 적당량(약 4~5g)을 채취한 후 밀봉하여 냉장 보관하고, 검사의뢰서와 용기에 채취 시간과 총 무게를 기재합니다.
채취 방법
뇌척수액(Cerebrospinal Fluid, CSF)
무균적으로 시행되는 요추천자를 통해 얻어지며, 검사별로 필요한 3~5 mL의 뇌척수액을 채취하여 검사에 이용합니다. 첫 번째 채취관에 얻어진 뇌척수액은 화학 및 면역검사를 위해 사용하고 두 번째는 미생물 염색 및 배양, 세번 째는 세포수 산정 및 감별계산, 네 번째로 기타 검사를 시행합니다.
-
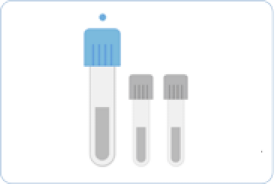
1번째 용기 : 화학 및 혈청검사
-

2번째 용기 : 세균검사
-
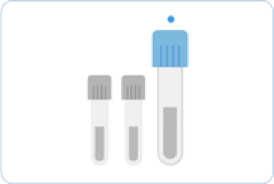
3번째 용기 : 세포 수 산정
양수(Amniotic Fluid, AF)
-
채취 시기
양수검사는 양수의 양 및 배양 가능한 세포수를 적절히 얻을 수 있는 임신 16~20주경에 천자를 시행하며 채취된 소량의 양수를 배양하여 염색체검사 및 생화학검사를 시행합니다.
- 채취 방법
- 초음파로 태아와 태반의 위치를 확인해가면서 복부 피부를 국소 마취한 후 가느다란 바늘을 이용하여 천천히 양수를 흡입하여 채취합니다. 채취 전 과정은 무균상태로 실시해야 하며, 채취 된 양수는 검사 필요량을 멸균용기에 옮겨 담아 밀봉하여 즉시 검사실로 보냅니다.
-
주의사항
양수 채취 시 모체 혈액이 오염되거나 15주 이내의 너무 이른 채취 및 양수 세포가 적은 경우 등 검체가 불량인 경우에는 양수를 다시 채취할 수 있습니다.

관절액(Synovial Fluid)
일회용 주사침으로 관절강을 천자하여 흡인 채취하며, 패혈증이나 관절주위 연부조직 감염 환자에서는 병원균이 오염되지 않도록 주의해야 합니다. 정상 활액은 응고되지 않으나 병적 상태의 관절에서 채취된 활액은 다량의 섬유소원을 함유하여 응고될 수 있으므로 헤파린 나트륨(sodium heparin, 25 U/mL)이 포함된 주사기를 이용하여 채취합니다. 옥살산(oxalate)이나 헤파린 리튬(lithium heparin) 항응고제는 결정을 형성할 수 있으므로 사용하지 않습니다.
기타 체액
- 미생물 검사 및 생화학검사 시행 시 항응고제 또는 응고촉진제가 첨가되지 않은 멸균용기를 사용합니다.
- 세포수 산정이나 세포감별에는 EDTA 항응고제 포함 용기를 사용합니다.
채취 방법
-

머리 후두부에서 3~4곳 나누어 소량의 머리카락 뭉치를 두피(모근)에 가깝게 (모근으로부터 0.3cm 이내) 가위를 이용하여 자릅니다.
-

두피로부터 3cm 이상의 머리카락은 버려주시고, 3cm 이내의 머리카락만을 종이 저울 "머리카락 놓는 곳"에 올려놓습니다.
-

머리카락 무게가 0.3g이 될 때까지 후두부 다른 여러 부위(약 5~7곳) 에서 충분한 양의 모발을 채취합니다.
- 염색, 퍼머, 탈색한 머리카락은 최소 2개월이 지난 후부터 표본으로 사용 가능합니다.
- 기능성 샴푸(탈모방지 등) 사용 시 최소 2~3주 후 검사가 가능합니다.
- 화학성분이 함유된 제품(스프레이 등)은 검사 당일 사용하지 않습니다.

